質量、物質量、相対質量、モル質量、質量数、原子量、分子量???
訳が分からなくなります。。。
この記事を読み終える頃には訳が分かるようになってる・・・といいですね 😆
気象予報士の試験の範囲としてはやや広げ過ぎかもしれませんが、基礎知識として必要ではないかと思います。
1.物質量と質量の関係
前回の記事で物質量の意味と物質量と粒子の個数との関係を取り上げました。
今回は物質量と質量の関係について学びます。また冒頭に挙げた似たような名称の意味も確認していきます。
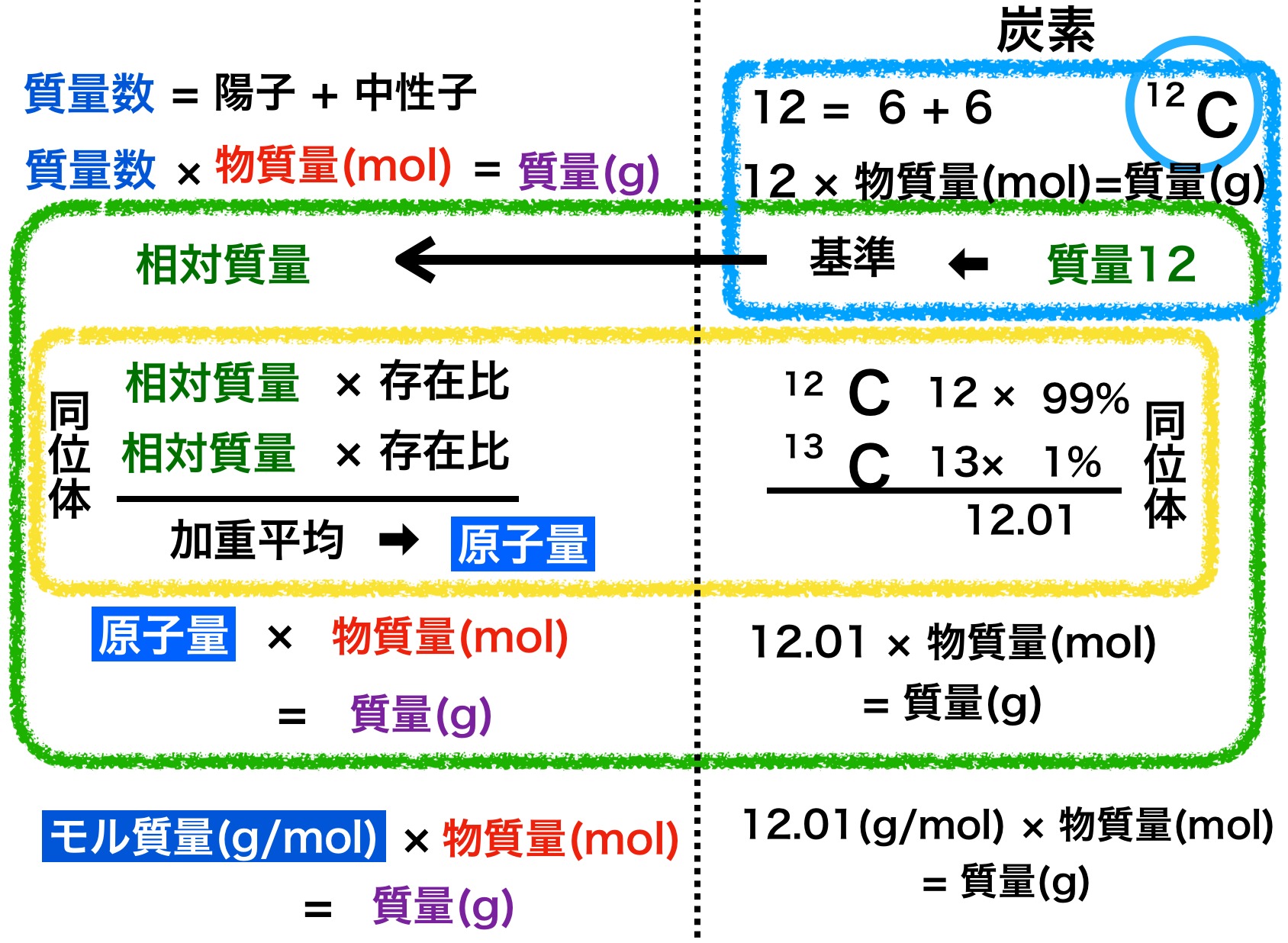
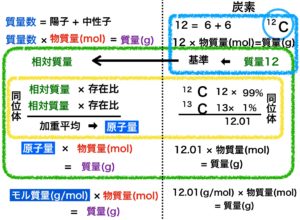
イメージ図の上から説明しますね。図の左半分が一般的な説明、右半分は炭素原子に当てはめての説明です。
2.質量数
質量数(単位なし) = 陽子数 + 中性子数
※ 炭素12の場合・・
質量数12 = 陽子数6 + 中性子数6
3.物質量
物質量・・・「物質の量を、その物質を構成する単位粒子の数によって表したもの。単位はモル。」(デジタル大辞泉)
1mol = 6.02 × 1023 個の粒子の集団
4.質量
質量(g)・・・非常におおざっぱに言えば 重さ
5.物質量 ⇒ 質量(質量数を用いて)
質量(g) = 質量数 × 物質量(mol)
※ 炭素12の場合・・
12g = 12g/mol × 1mol
質量数には単位はありませんが計算のために付けました。
6.相対質量
相対質量(単位なし)・・・炭素12の質量を12としたとき、これを基準に他の原子の質量を相対的に比べたもの
よって 質量数=相対質量 となります。
7.同位体
同位体・・・ 原子番号(陽子数)は同じだが,中性子数が異なる原子同士
※ 炭素原子の場合
炭素12(中性子数6) 全体の約99%
炭素13(中性子数7) 全体の約1%
8.原子量
原子量(単位なし)・・・各同位体の相対質量の加重平均
加重平均は各同位体の相対質量にそれぞれの存在比をかけて足した値となります。
※ 炭素原子の場合
炭素12 ⇒ 12 × 99 ÷ 100 = 11.88
炭素13 ⇒ 13 × 1 ÷ 100 = 0.13
11.88 + 0.13 = 12.01
となります。
分子量・・分子は原子の集合ですから原子の総数を求めて同様に計算できます。
式量・・分子量と同じく原子の総数を求めて計算します。
9.物質量 ⇒ 質量(原子量を用いて)
質量(g) = 原子量 × 物質量(mol)
※ 炭素原子の場合
12.01g = 12.01g/mol× 1mol
原子量には単位はありませんが計算のために付けました。
10.モル質量
モル質量 (g/mol )・・・原子(分子)1molあたりの質量
原子量(分子量)と同じ数値ですが単位 (g/mol) が付いています。
11.物質量 ⇒ 質量(モル質量を用いて)
質量(g) = モル質量(g/mol) × 物質量(mol)
※ 炭素原子の場合
12g = 12.01g/mol× 1mol
となります。
12.物質量と質量の関係(まとめ)
質量(g) = モル質量 (g/mol)× 物質量(mol)
物質量(mol) = 質量(g) ÷ モル質量 (g/mol)
次回は物質量と気体の体積の関係を含め、物質量のまとめに入ります。