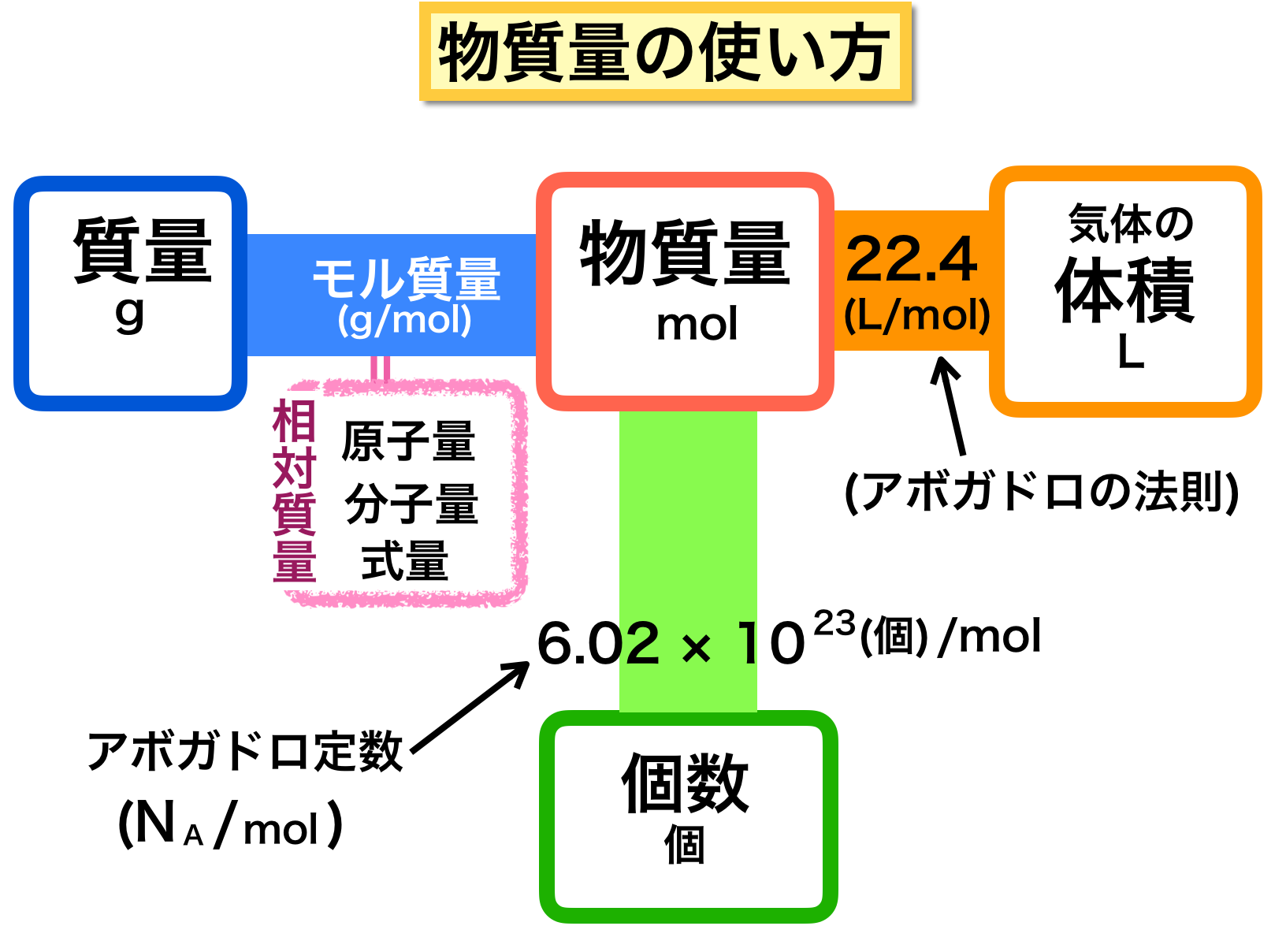
気象を学ぶ上で物質量 (mol) という単位が役立つのは気体、つまり大気に関わる分野でしょう。
それで、今回は以下の点を取り上げます。
a) 地球大気の平均分子量
b) 物質量と気体の体積との関係
c) 物質量のまとめ
1.分子量(図の左側)
分子量とは・・分子を構成する元素の原子量の合計
ですから原子量と同様に単位はなく、物質量と質量との変換方法も原子量と同じ計算式を用いることができます。
式量についてはここでは省略しますが、やはり原子量の合計を求めて計算できます。
2.地球大気の平均分子量
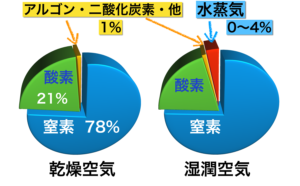
大気を構成する分子の容積比率は円グラフ(左側)にある通りです。
微量となる二酸化炭素と水蒸気を除くと容積比と分子量は次の表で表せます。
| 窒素N2 | 酸素O2 | アルゴンAR | |
| 分子量 | 28 | 32 | 40 |
| 容積比 (%) | 78 | 21 | 1 |
さて、同位体のある原子の原子量を導き出す時に加重平均を用いました。同じように、平均分子量も加重平均を求める方法で次のように計算できます。
28×78÷100 + 32×21÷100 + 40×1÷100 = 28.96
これは水蒸気H2O を含まない乾燥空気の値です。
◎ 水蒸気を含む湿潤空気だと、値はどう変わるでしょうか?
水蒸気の分子量は 18 で乾燥空気の平均分子量より小さいため、水蒸気を含む湿潤空気の平均分子量は 28.96 より値が小さくなります。
ですから乾燥空気より湿潤空気の方が空気密度が小さく軽いということが分かります。
3.気体の体積と物質量の関係(イメージ図の右側)
図の右側に 22.4(L/mol) とありますね。これは次のような意味です。
標準状態(0℃,1気圧)においてはすべての気体 1mol の体積は22.4 L(リットル)である。
質量や個数の場合と同様に、物質量から気体の体積、気体の体積から物質量を求めることができます。変換式は次の通りです。
体積(L) = 物質量(mol) × 22.4(L/mol)
物質量(mol) = 体積(L) ÷ 22.4(L/mol)
4.アボガドロの法則
アボガドロの法則・・・同温、同圧のもとで、すべての気体は同じ体積中に同じ数の分子が含まれる
この法則は上記の気体の体積と物質量の関係から導き出せますね。そういう意味でカッコつきで書きました。
アボガドロの法則については、気体の状態方程式とのかかわりの中でまた取り上げます。
5.物質量のまとめ
イメージ図全体を見てください。
ここまでの3つの記事を通して、物質量と、粒子(原子・分子)の個数、質量、気体の体積を結びつける方法を考えてきました。
計算方法について以下を覚えておくと便利です。
A 物質量から 個数、質量、体積 を求める場合は掛け算
B 個数、質量、体積から 物質量を求める場合は割り算
例えば、炭素原子(同位体を含む)が2mol あるとすると
● 原子の個数は
2mol×6.02×1023 (個)/mol = 12.04×1023 (個)
● 質量は
2mol × 12.01g/mol = 24.02g
● 体積は
2mol × 22.4L/mol = 44.8L
となります。
物質量を求める場合は上の式を変形すればできますね。
物質量、モル(mol)、アボガドロ定数などが分かったところで、次回から本題に入っていきます。
ボイル・シャルルの法則、気体の状態方程式などです。このブログの初期の頃にちょっとかじりましたが、これから “ちゃんと”⁇ 取り組んでいく所存です。よろしく 😉