物の大きさは定規が、重さは秤があれば測れます。では物の中身…原子・分子の数はどうやって測る?ここで物質量 (mol) の出番です。
前回の記事で、原子や分子といった非常に小さな質量の物を数える時にモル (mol) を使うと便利だと学びました。
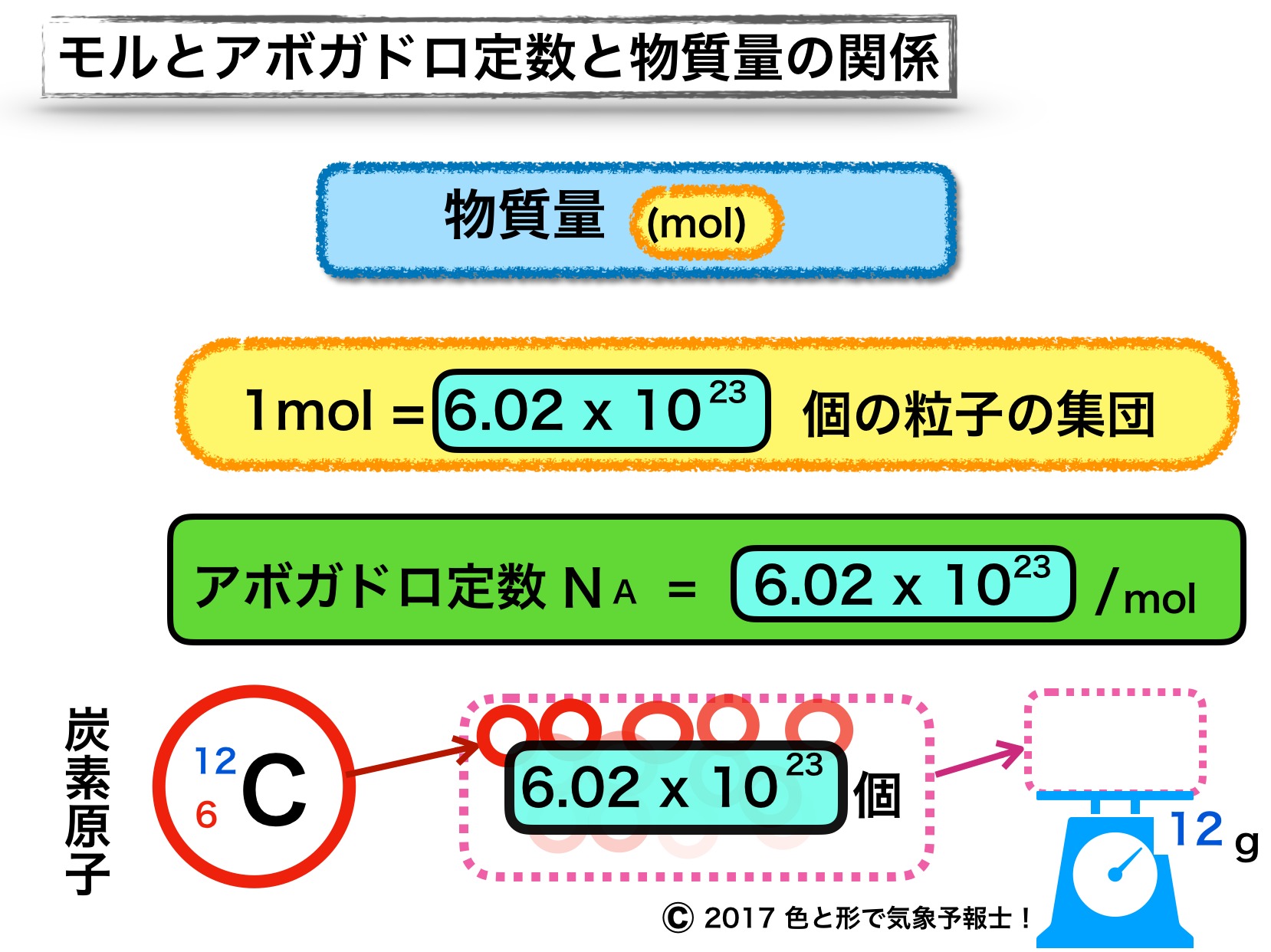
今回は「物質量 (mol)」と「アボガドロ定数」の意味、物質量と粒子の個数 間の変換について調べていきます。上記図を下から目で追ってください。
1.モル誕生まで(前回の復習)
◆ 気象学では気体分子を扱う
◆ でも、分子や原子は小さくて数が多いので扱いづらい
◆ なので、一定数を 1つのまとまりにして扱おう
◆ 炭素12 をたくさん集めて12g にしたら何個かな?
◆ 6.02 × 1023 個あった
◆ この数を「モル」と呼んで次のように定義しよう
◆ 1mol = 6.02 × 1023 個の粒子の集団
(モルは気象学の必要から生まれたわけではないでしょうが、ここでは気象学の一部として考慮するので、このような流れで表現しました)
2.アボガドロ定数
6.02 × 1023 という数字は「アボガドロ数」と名付けられました。
また、モル単位のアボガドロ数を「アボガドロ定数」と言い NA という記号で表しています。
現在ではアボガドロ定数を用いることが多いようです。
アボガドロ数 = 6.02 × 1023
アボガドロ定数 NA = 6.02 × 1023 /mol
3.物質量
物質量とは・・
「物質の量を、その物質を構成する単位粒子の数によって表したもの。単位はモル。」(デジタル大辞泉)
気体を量的に扱う場合、以下の表し方があります。
● 質量 (g)
● 体積 (L)
● 粒子の個数(個)
● 物質量(mol)
4.物質量と個数、質量、体積の関係
物質量(mol) は粒子(原子、分子など)の個数、質量、気体の体積を表す時に使える便利な単位です。
この後、数回の記事を通して物質量から粒子の個数、質量、気体の体積を求める計算式、またその逆を求める計算式を取り上げていきます。
先に結論となる式を挙げてしまうと以下のようになります。
物質量(mol) = 個数 ÷ 6.02 × 1023 / mol
= 質量(g) ÷ モル質量(g/mol)
= 体積(L) ÷ 22.4(L/mol)
モル質量は原子量、分子量、式量に置き換えることができます。
5.物質量と粒子の個数の関係式
上記の中で1番分かり易いのは物質量と粒子の個数との変換方法でしょう。
物質量と粒子の個数との関係を式にすると、こうなります。
個数 = 物質量(mol) × 6.02 × 1023 / mol
物質量(mol) = 個数 ÷ 6.02 × 1023 / mol
例えば
物質量2mol で個数を求める時は
2(mol) × 6.02 × 1023 / mol = 12.04 × 1023
個数が3.01 × 1023 で物質量を求める時は
3.01 × 1023 ÷ 6.02 × 1023 / mol = 0.5mol
となります。
次回以降、物質量と質量、体積の関係を調べていきます。
質量に関しては原子の質量数と似て非なるもの「原子量(分子量)」、さらに「モル質量」の意味を先に取り上げる予定です。ではまた