空気分子を扱う時モル(mol) という単位を使いますが、1mol は 6.02×10の23乗 個の粒子の集団です!って何でこんな中途半端な数字にになるのでしょう?
また、モルは以前にもちょっと触れた アボガドロの法則にも関係します。
ということで この記事ではモル誕生のいきさつを辿って熱力学の土台を据えていきます。
1. モル (mol) 誕生の訳
ほとんどの気象現象には気体が関わっています。気体は窒素・酸素・アルゴン・二酸化炭素といった種類から成る、たくさんの分子で構成されています。
「たくさん」というのは おおざっぱ過ぎるので、ちゃんと数で数えたいですね。でも、熱力学で扱うには気体分子の数はあまりに膨大で数え切れるものではありません。
そこで、一定数の原子・分子を ひとまとまり にして、そのまとまりが どれだけあるかで原子・分子の数を捉えようという考えの流れの中で モルという単語が生まれました。
では、いつものようにイメージ図を使ってモルの意味を考えていきましょう。
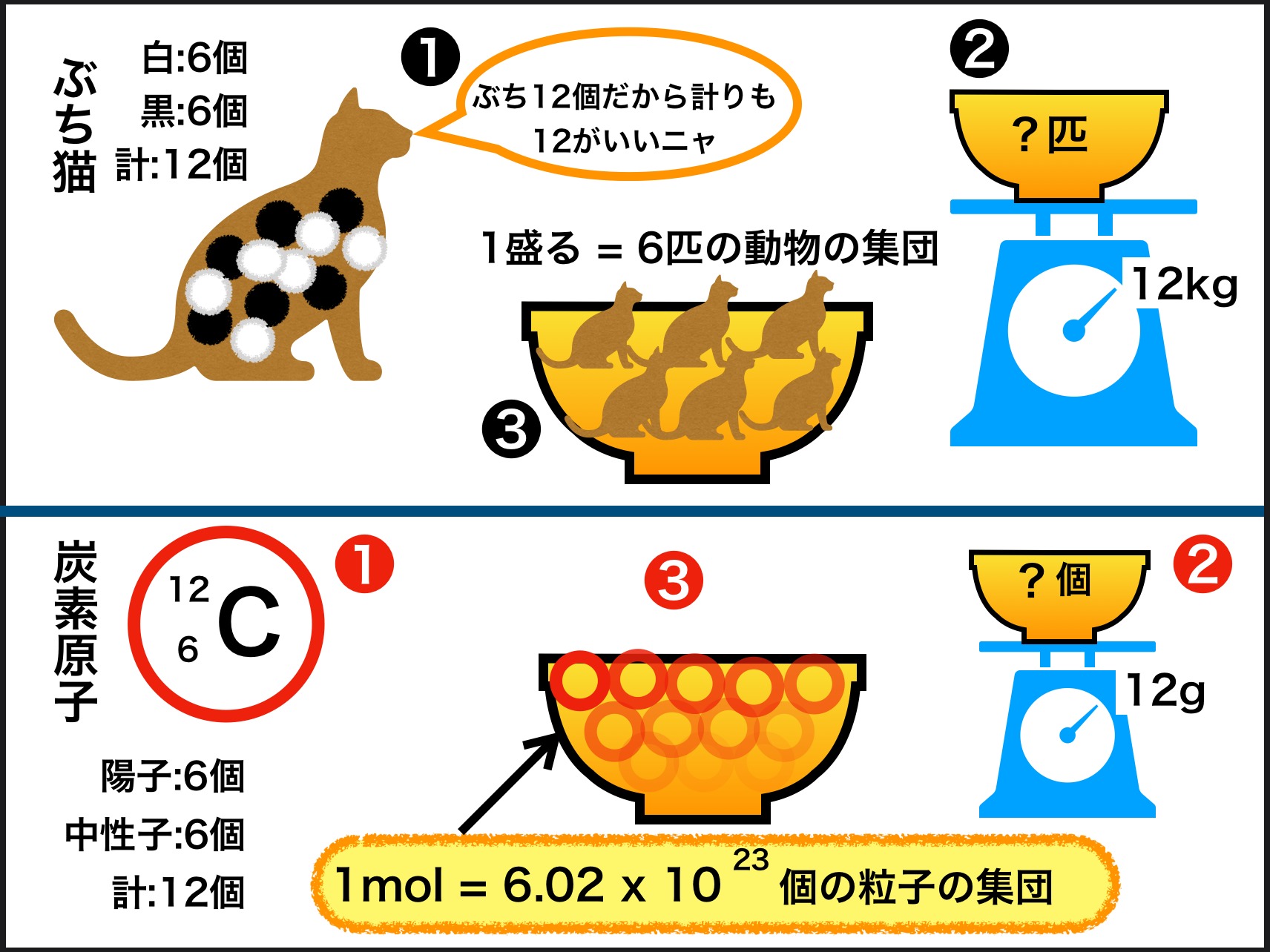
2.ブチ猫の主張(冒頭の図の上半分)
モルという単位が必要になった過程を猫の例えでたどっていきます。
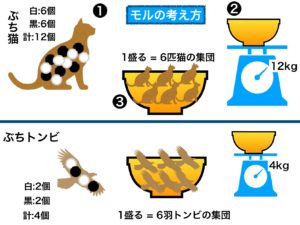
● 白いブチ6個と黒いブチ6個、合計12個のブチがある猫がいたとします。❶
● この猫は体重が 2㎏ ですが、その数字が気に食わないようです。
● 「ブチが12個あるんだから、12という数字にしてくれ」とわがままを言いだします。
● それでお椀を一つ秤(はかり)に乗せて、その中にブチ猫をブチ込むことにします。❷
● 当然、1匹では 12㎏ にならないので、自分と同じ数のブチがある仲間の猫を連れて来てもらい、秤の針が 12㎏ を指すまで乗せていきます(お椀の重さは引いてあります)。
● 針が 12㎏ を指したところでお椀の中を見ると6匹のブチ猫が入っているのが分かります。❸
● わがまま猫は満足げに言いました。「僕の重さは12ニャー」
● さて、このお椀に6匹の猫が入るのが分かったので、< 1盛る=6匹の動物の集団 >ということにして「盛る」という単位を作ることにしました。
3.ブチトンビでは・・
今度はブチのあるトンビにも登場してもらいます。
このトンビは白のブチ2個と黒のブチ2個、合計4個のブチを持っています。
ブチ猫と同じように秤がブチの数4個と同じ4㎏になるようお椀に入れていくと、丁度6羽になります。
猫の場合と同じ数になる訳はブチのある動物はブチの数だけの体重があるという前提にしたからです。
少し例えが長くなってしまいましたね。では、これから猫を炭素原子に置き換えて考えていきます。
4.炭素原子の表現方法 (下の図の左下 ❶ )
簡単に元素の表し方を復習します。
4-1. 元素記号
◎ アルファベット・・元素名
◎ 元素名の左上の数字・・質量数 = 陽子の数+中性子の数
◎ 元素名の左下の数字・・原子番号 = 陽子の数
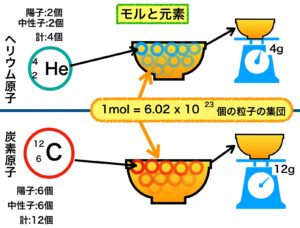
4-2. 炭素原子の場合
◆ 元素名⇒ C
◆ 質量数 ⇒ 陽子数+中性子数=12(同位体については後述)
◆ 原子番号 ⇒ 陽子数=6
◆ 質量数-原子番号(陽子数)=中性子数 = 6
5.炭素12を12gにする (図の右下 ❷)
炭素12 の1個分の質量は
1.99 × 10-23 g です。
この数字はあまりに小さく実用的ではないので、猫の例えで使ったように1まとまりにして扱うことにしています。
その まとまりを、炭素12 を集めて来て丁度 12g になった時の個数分にしようということになりました。
炭素12 の12を取って 12g 。。。分かり易いですね。
6.モル( mol )とは (上の図の中央下 ❸)
そのひとまとまりに炭素12が幾つ入っているか見たところ、
6.02 × 1023 個
ありました。そこでモルという単位を作って
1mol = 6.02 × 1023 個 の粒子の集団
と定義しました。(※)
mol は分子を意味する英語の molecule から来ています。
7.ヘリウム原子の場合
ヘリウム原子は質量数が4です。
この数と同じ 4g にするには炭素原子同様 6.02 × 1023 個のヘリウム原子、つまり 1mol が必要です。
これは、陽子・中性子の質量はどんな元素でも同じだからです。
8.アボガドロ数
6.02 × 1023 という数字を「アボガドロ数」と言います。
モル(mol) とアボガドロ数については次回以降さらに考察していきます。
9. 炭素原子を基準とした理由
例えば質量数1の水素原子を基準としてもいいはずですが、炭素原子を基準とした主な理由は以下の通りです。
● 他の様々な原子と化合できるため質量比較がしやすい
● 炭素13などの同位体(後述)の存在比が極めて小さい
10.電子
電子の質量は非常に小さいので電子の数は質量に影響しないとみなします。ですから原子・分子の質量は陽子と中性子を足した数、つまり質量数で表現できます。
11.同位体
同位体・・ 原子番号(陽子数)は同じだが,中性子数が異なる原子同士
炭素の99% ⇒ 炭素12(陽子6個+中性子6個=質量数12)
炭素の1% ⇒ 炭素13(陽子6個+中性子7個=質量数13)
実際の原子・分子の質量を考える上では同位体も考慮しなければなりませんが、分かり易くするため、この記事では炭素12だけで考えています。
(※) mol の定義は最近変わりましたが、分かり易い旧定義を用いています。
気象学では mol という単位は知ってることを前提として論じられていますね。高校で物理と化学をドロップアウトした私ですが、理解できると結構面白いです。ではまた 😮