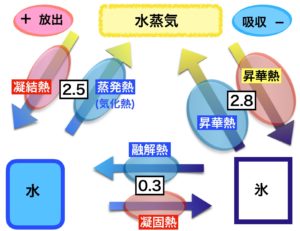
潜熱、特に凝結熱は気象現象に大きく関わっていますが、非理系人間にとっては難所の一つです。確実に理解できるのは、2.5+0.3=2.8 という数式です。
少し前の記事で3態の状態変化の関係図と、それに関わる呼び方、つまり種類を示した図を載せました。上記の図はその図に状態変化ごとの潜熱の種類と熱量を示したものです。
少し複雑な図になっているので順に説明していきます。
1.初めに
1-1 ピンクの楕円・・熱を放出する
1-2 水色の楕円・・熱を吸収する
1-3 数字・・潜熱量の概数
● 実際には図で示された数字に 106 を掛け、単位は J (ジュール)です。
● 熱を放出する場合は正(+)、吸収する場合は負(-)の符号が付きます。
2.蒸発熱(気化熱)
● 水(液体)から水蒸気(気体)へと状態変化する時に吸収する熱
● 周りの物質(空気等)から熱を奪うので物質(空気等)の温度が低下します。(以下、物質を大気とします)
● 値は -2.5×106 J/kg
3.凝結熱
● 水蒸気(気体)から水(液体)へと状態変化する時に放出する熱
● 周囲の大気に熱を放出する奪うので気温が上昇する
● 値は +2.5×106 j/kg
4.融解熱、凝固熱
● 氷と水との状態変化も水と水蒸気との状態変化と同様の仕組みになります。
● 値は -0.3×106 j/kg (融解熱) +0.3×106 j/kg(凝固熱)
5.昇華熱
● 氷から直接水蒸気になる状態変化と水蒸気から直接氷になる状態変化は、どちらも昇華熱と呼びます。
● 値は -2.8×106 j/kg (氷から水蒸気) +2.8×106 j/kg(水蒸気から氷)
この 2.8 という数字は、水と水蒸気の状態変化の 2.5 と 氷と水の状態変化の 0.3 を足した値になっています。
6.熱量の単位
● 熱量の単位にはカロリー (cal) とジュール (J) があります。
● 1cal は水1gを1℃上昇させる熱量です。
● 両者の関係は 1cal = 約4.2J となります。
個人的には、水から水蒸気への変化など、潜熱を吸収する仕組みは理解しやすいのですが、逆の過程、水蒸気から水への変化で潜熱を放出するというのは、どうしてもしっくり理解できないです。
もっとイメージし易くなったら、どこかの記事で紹介したいと思います。