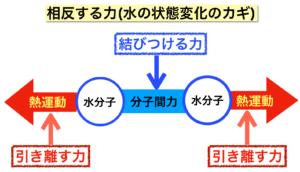
水分子を引き離そうとする力と、結びつけようとする力、これら相反する力のせめぎ合いが水の状態変化と潜熱を理解するカギです。これら2つの力の争いが終わらない限り温度変化はありません。そのことをこれから考えていきます。
1.熱運動と分子間力
引き離そうとする力は熱運動です。熱運動が激しければ分子たちはそれぞれ行きたい方向へ行こうとして互いに離れようとします。
結びつける力は分子間力です。何とか分子と分子を結びつけようとします。分子間力が何なのか・・ 深入りしそうなのでやめておきます(ホントはよく分からない?)。
2つの力をイメージ図で表現しました。
この図を頭に入れながら前回の記事に載せた3態を表す図をもう一度ご覧ください。
● 熱運動が弱い時、つまり温度が低い時は水分子同士の分子間力が目一杯働いて分子同士が規則正しく並びます。これが固体(氷)の状態です。
● 熱運動が中くらいの時、つまり温度が高くも低くもない時は水分子と他の水分子との間の分子間力は部分的に働くに過ぎません。これが液体(水)の状態です。
● 熱運動が激しい時、つまり温度が高い時は分子間力は完全に働かなくなります。これが気体(水蒸気)の状態です。
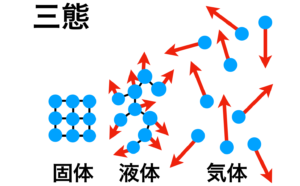
このように水の3つの状態には分子間力による分子同士の結びつき具合が関わっていることが分かります。この結びつきをプチプチ切って行くには外部からの熱エネルギーの供給が必要とされます。
2.顕熱
氷に熱エネルギーを加えていくと水分子の運動量は大きくなります。つまり温度が上昇します。この時の熱エネルギーは顕熱と言えます。
ただ、水分子がそれぞれ行きたい方向に行こうとしても、分子間力によってがんじがらめにされていて隙間もほとんどありません。
結局個々の水分子は所定の位置でプルプル振動している、そんなイメージになります。
3.潜熱
さらに熱エネルギーを加えて行き温度が0℃になると、水分子の一部は所定の位置にとどまるのに耐え切れずに分子間力の一部をプチっと切って行きたい方へ行こうとします。つまり氷から水になろうとします。
ただ、分子間力も黙って切られる訳にはいきません。切られまいとする分子間力を切るには力が要ります。
それで氷に加えられている熱エネルギーは水分子の運動を後押しするのを一旦やめて、分子間力の切断に専念し始めます。この時の熱エネルギーは潜熱と言うことができます。
ですから氷から水に変わる時には、その作業が完了するまでは温度の上昇はみられず0℃のままということになります。
同様のプロセスが水から水蒸気への変化にも当てはまります。次回以降、もう少し理解を深めていこうを思います。